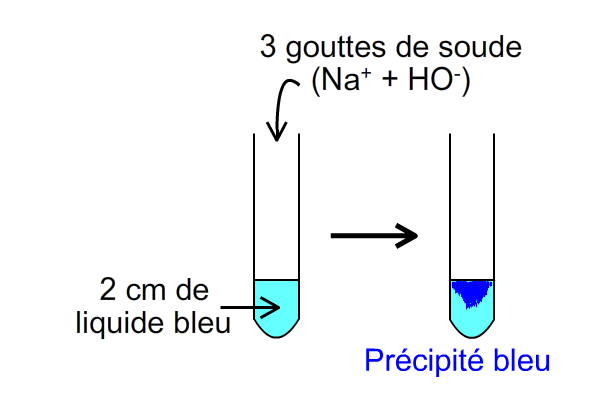
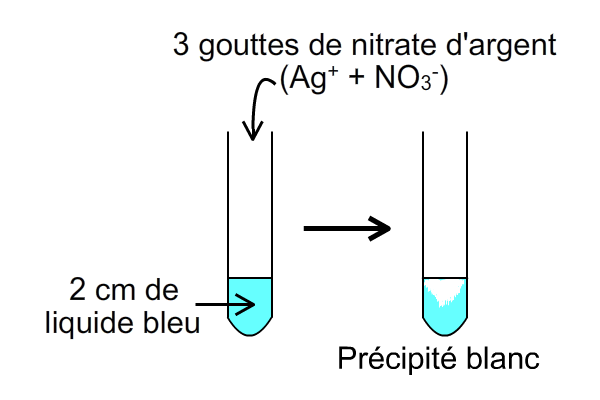
Pour vérifier la présence d'un ion dans un liquide (une solution), on peut réaliser un test chimique en versant quelques gouttes d'un produit dans un peu de ce liquide placé dans un tube à essais.
Exemple :
-
Pour vérifier la présence des ions fer (II) Fe2+ dans un liquide, on verse dans un tube à essais 2 cm de liquide puis quelques gouttes de soude.
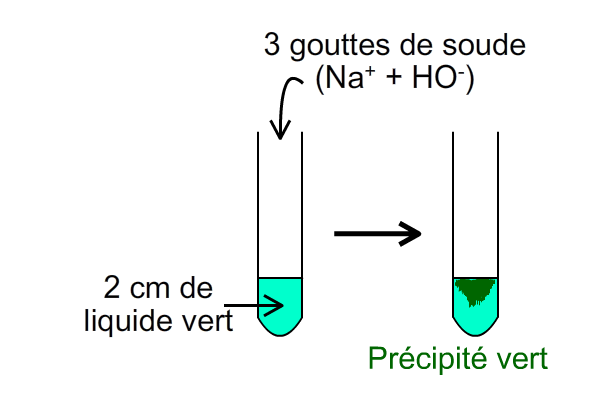
-
Observation :
On observe. Un précipité vert se forme. -
Interprétation :
Conclusion, le liquide contient des ions fer (II) Fe2+.